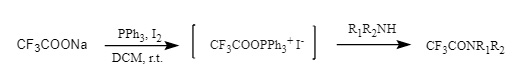1. Introducción
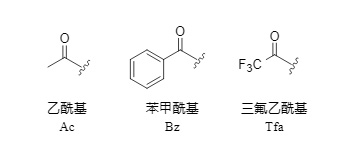
Los grupos monoacilo son una clase diversa de grupos protectores de amino ampliamente utilizados en la síntesis de péptidos y fármacos. Entre ellos, el acetilo, el benzoilo y el trifluoroacetilo son los más utilizados (Figura 1). El trifluoroacetilo, en particular, es muy utilizado en la síntesis de péptidos debido a su conveniente método de eliminación, ideal para estrategias de protección ortogonal.
Figura 1 Grupos protectores monoacilo comunes
Los grupos acetilo y benzoilo carecen de grupos electroatractores fuertes y suelen requerir condiciones de hidrólisis severas para su eliminación, lo que puede causar fácilmente la racemización de polipéptidos y la eliminación de otros grupos protectores. Por lo tanto, su campo de aplicación está sujeto a ciertas limitaciones.
2. Grupos acilo no halogenados
Debido a la fuerte capacidad de atracción de electrones del trifluoroacetilo, sus propiedades difieren significativamente de las del benzoílo y el acetilo. Por lo tanto, este artículo clasifica el benzoílo y el acetilo como grupos acilo no halogenados y los describe de forma uniforme.
1. Método de introducción
(1) Método convencional:
Los métodos convencionales de introducción de grupos acilo suelen utilizar anhídrido de ácido/cloruro de acilo para introducir grupos acilo mediante acilación en presencia de una base, o bien mediante una reacción de acoplamiento de ácido carboxílico y amina con la promoción de un reactivo de condensación. Tomando el acetilo como ejemplo (Figura 2), los métodos de introducción de cloruro de acetilo y anhídrido acético son los siguientes:
Figura 2 Método de introducción de grupos acetilo
(2) Métodos especiales:
① Método de amidas.
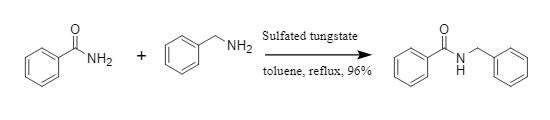
Pathare et al. desarrollaron una reacción de transamidación catalizada por tungstato modificado. Mediante la catálisis del tungstato modificado, las amidas y los compuestos amínicos reaccionan para convertirse en nuevos compuestos amínicos (Figura 3). Este método es aplicable a diversas amidas aromáticas y alifáticas, con condiciones de reacción suaves y alta eficiencia.
Figura 3 Reacción de transamidación catalizada por tungstato modificado
②Método del N-acilbenzotriazol.
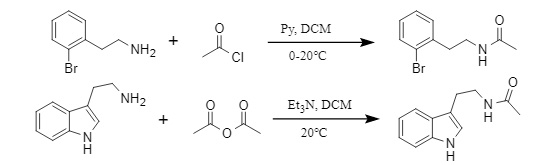
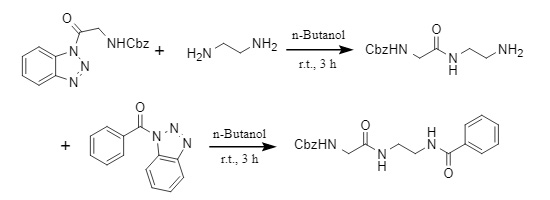
Agha et al. desarrollaron un nuevo método de introducción de acilo. Utilizando acilbenzotriazol como agente acilante, pueden monoacilar selectivamente diaminas aromáticas/alifáticas no protegidas en disolventes verdes como el agua y el n-butanol. Al mismo tiempo, también pueden acilar gradualmente diaminas alifáticas para sintetizar diamidas asimétricas (Figura 4).
Figura 4 Síntesis de diamida asimétrica
2. Método de desacilación:
La estabilidad del enlace amida es relativamente alta, y la desacilación en condiciones suaves es más difícil. En comparación con la hidrólisis del grupo éster, la hidrólisis del grupo amida suele requerir condiciones más intensas.
(1) Método convencional:
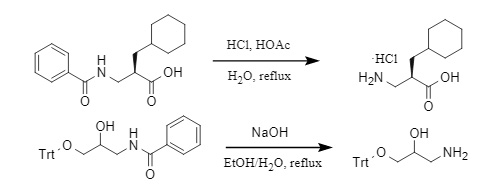
Generalmente, el grupo acilo solo puede eliminarse mediante una reacción a alta temperatura en condiciones fuertemente ácidas/alcalinas. Tomando el benzoilo como ejemplo (Figura 5), la desacilación se lleva a cabo en condiciones ácidas y alcalinas, respectivamente.
Figura 5 Método para eliminar el grupo benzoilo
(2) Métodos especiales:
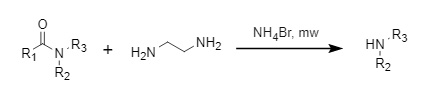
① Método de bromuro de amonio
Shimizu et al. desarrollaron un método de desacilación asistido por microondas utilizando la acción sinérgica del bromuro de amonio y la etilendiamina, que tiene un alto rendimiento y es compatible con una variedad de grupos funcionales (Figura 6).
Figura 6 Desacilación sinérgica de bromuro de amonio y etilendiamina
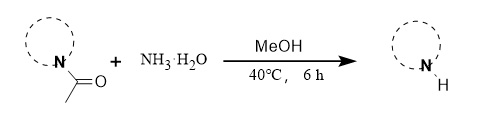
② Método del amoníaco:
El equipo del profesor Zeng desarrolló un método de desacilación suave utilizando amoníaco como reactivo. Las condiciones de reacción son suaves y el rendimiento es alto. Es aplicable a diversos compuestos, como diversos indoles sustituidos (Figura 7).
Figura 7 Reacción de desacilación del amoníaco
3. Haloacilo
Los grupos haloacetilo se eliminan con mayor facilidad bajo la influencia de átomos de halógeno. Entre ellos, el grupo protector representativo trifluoroacetilo puede eliminarse en condiciones alcalinas suaves y se utiliza ampliamente en la síntesis de péptidos y fármacos.
1. Método de introducción
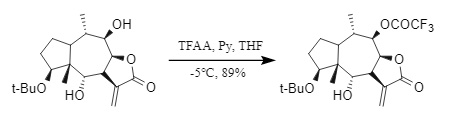
(1) Anhídrido trifluoroacético (TFAA): El anhídrido trifluoroacético es altamente activo y generalmente requiere una temperatura más baja y la presencia de una base (Figura 8). Es un reactivo común en la trifluoroacetilación, pero al introducirse en Tfa, es fácil provocar reacciones secundarias como la racemización del centro quiral o la ruptura del enlace peptídico.
Figura 8 Anhídrido trifluoroacético introducido en Tfa
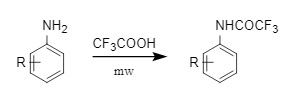
(2) Ácido trifluoroacético (TFA): Comparado con el anhídrido trifluoroacético y el cloruro de trifluoroacetilo, el ácido trifluoroacético presenta un punto de ebullición más alto y una gama más amplia de aplicaciones. Puede utilizarse para trifluoroacetilar anilinas sustituidas en condiciones asistidas por microondas (Figura 9). También puede introducirse mediante una reacción clásica de condensación de ácido carboxílico con amina o para trifluoroacetilar directamente aminas aromáticas mediante calentamiento en xileno.
Figura 9 Ácido trifluoroacético introducido en Tfa
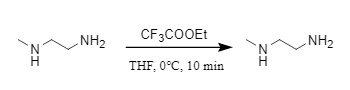
(3) Trifluoroacetato de etilo: El trifluoroacetato de etilo se utiliza comúnmente en la síntesis de péptidos y se puede obtener mediante la reacción con aminas a 0 °C en THF. Bajo la influencia del impedimento estérico, este reactivo puede proteger selectivamente las aminas primarias en presencia de aminas secundarias (Figura 10). Incluso para la misma amina primaria, diferentes grupos alquilo tendrán diferentes efectos de reacción. Por ejemplo, en presencia de terc-butilamina e isobutilamina, reaccionará preferentemente con isobutilamina, que presenta un menor impedimento estérico (que representa el 98%).
Figura 10 Introducción de Tfa en trifluoroacetato de etilo
(4) Sales de aciloxifosfonio: Las sales de aciloxifosfonio de yodo/bromuro se prepararon con trifluoroacetato de sodio/trifenilfosfina/yodo o ácido trifluoroacético/trifenilfosfina/NBS, y luego se atacaron con aminas para dar trifluoroacetamidas (Figura 11).
Figura 11 Introducción de sal de aciloxifosfonio en Tfa
(5) Otros reactivos:
Muchos de los reactivos introducidos son derivados del ácido trifluoroacético/anhídrido trifluoroacético. Mediante la síntesis de derivados con grupos de fácil eliminación, como el acil imidazol, el acil benzotriazol, etc., reaccionan con aminas para obtener las amidas correspondientes.
2. Métodos de eliminación:
El método de eliminación del trifluoroacetilo es relativamente suave y estable en condiciones de acidez fuerte. Es compatible con grupos protectores como Boc, Z, Trt y Alloc. Los siguientes métodos de eliminación se utilizan comúnmente:
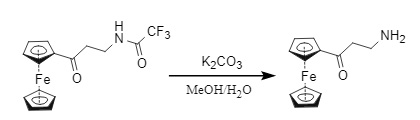
(1) Na₂CO₃ (K₂CO₃)/MeOH/H₂O (Figura 12)
Figura 12 Eliminación de carbonato de Tfa
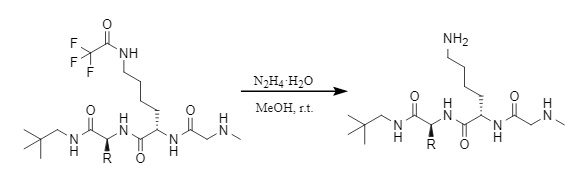
(2) Hidrato de hidrazina/metanol
Figura 13 Eliminación de Tfa por hidrato de hidrazina
(3) Otros métodos:
Además de los métodos de desacilación anteriores, existen varios métodos de eliminación suaves, que incluyen solución acuosa de NaOH, solución acuosa de piperidina 1 M, NaBH4/EtOH y otros métodos.
Referencias:
[1] Guo Yanhao, Hao Qinghui, Hao Siyuan, et al. Protección y desprotección de grupos amino en productos químicos [J]. Industria química y del carbón, 2022, 45, 106-112.
[2] Gao Xuhong, Li Bingqi. Protección de aminoácidos y aplicación en síntesis orgánica (revisión) [J]. Revista de la Universidad de Shihezi (Edición de Ciencias Naturales), 1999, 3, 76-86.
[3] Balieu, S.; Toutah, K.; Rousselière, H.; et al. Ciclación radical de ynamidas en anillos de seis u ocho miembros. Aplicación a la síntesis de un análogo de protoberberina [J]. Tetrahedron Lett., 2011, 52, 2876-2880.
[4] Warren, HT; Saeger, HN; Rasmussen, K.; et al. Inhibidores psicoplastógenos de DYRK1A con efectos terapéuticos relevantes para la enfermedad de Alzheimer [J]. J. Med. Química, 2024, 67, 6922-6937.
[5] Pathare, AP; Jainista, AKH; Akamanchi, KG Tungstato sulfatado: un catalizador altamente eficaz para la transamidación de carboxamidas con aminas [J]. RSC Adv., 2013, 3, 7697-7703.
[6] Agha, KA; Abo-Dya, ND, Abdel-Samii, ZK; et al. N Acilbenzotriazol: enfoque conveniente para la monoacilación libre de grupos protectores de diaminas simétricas [J]. Monatsh. Chem., 2020, 151, 589–598.
[7] Doboszewski, B., Groaz, E., Herdewijn, P. Síntesis de unidades de esqueleto de fosfonoglicina para el desarrollo de ácidos nucleicos fosfopéptidos [J]. Eur. J. Org. Chem., 2013, 4804–4815.
[8] Benkel, T.; Annala, S.; Gütschow, M.; et al. Fragmentos BIM-46174 como ligandos potenciales de proteínas G [J]. Med. Chem. Commun., 2019, 00, 1-3.
[9] Shimizu, Y.; Morimoto, H.; Zhang, M.; Ohshina, T. Deacilación asistida por microondas de amidas inactivadas mediante transamidación acelerada con sal de amonio[J]. Angew. Chem. Int. Ed. 2012, 51, 8564–8567.
[10] Han Qun, Xu Kun, Zeng Chengchu et al. Un método práctico para eliminar grupos protectores de acilo mediante la reacción de amidotransferencia[J]. Organic Chemistry, 2022, 42, 1123-1128.
[11] López, SE; Restrepo, J.; Salazar, J. Trifluoroacetilación en síntesis orgánica: reactivos, desarrollos y aplicaciones en la construcción de compuestos trifluorometilados[J]. Curr. Org. Synth., 2010, 7, 414-432.
[12] Piotrowicz, M.; Maslowska, N.; Rudolf, B.; et al. Síntesis de trifluoroacetamidoketonas por acilación de ferroceno con aminoácidos protegidos in situ [J]. J. Org. Chem., 2025, 90, 2958-2968.
[13] Heller, P.; Weber, B.; Birke, A.; Barz, M. Síntesis y desprotección secuencial de copolipéptidos tribloque utilizando química de grupos protectores ortogonales [J]. Macromol. Rapid Commun., 2015, 36, 38-44.
[14] Isidro-Llobet, A.; Álvarez, M.; Albericio, F. Grupos protectores de aminoácidos [J]. Chem. Rev., 2009, 109, 2455-2504.