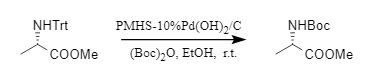Los grupos protectores tritilo presentan impedimentos estéricos, ofrecen condiciones suaves de introducción y eliminación, son fáciles de operar y presentan una alta estabilidad, lo que los hace especialmente adecuados para la protección selectiva de compuestos multifuncionales. Además, la introducción de grupos protectores tritilo facilita la cristalización, facilitando así la purificación mediante cristalización.
1. Introducción
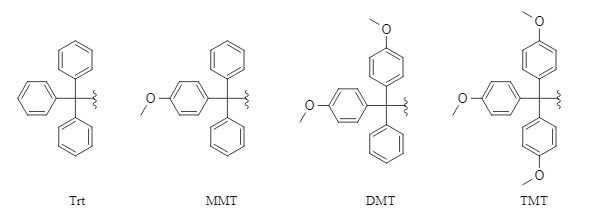
Los grupos protectores tritilo comunes incluyen
tritilo (Trt), 4-metoxitritilo (MMT), 4,4'-dimetoxitritilo (DMT) y 4,4',4"-trimetoxitritilo (TMT) (Figura 1) . Esta serie de grupos protectores es relativamente estable en condiciones alcalinas o en presencia de nucleófilos, pero se elimina fácilmente en condiciones ácidas. La actividad de eliminación en condiciones ácidas es del siguiente orden: TMT > DMT > MMT > Trt. Dado que los métodos de introducción y eliminación de esta serie de grupos protectores son generalmente similares, este artículo se centra en Trt como ejemplo.
Figura 1 Estructuras comunes de grupos protectores de series tritilo
2. Método de introducción
Debido a su importante impedimento estérico, los grupos protectores tritilo se utilizan comúnmente para proteger aminas primarias. Su funcionalidad es similar a la del trifluoroacetato de etilo y la N-etoxicarbonilftalimida, lo que permite la protección selectiva de aminas primarias. Además, en la síntesis de péptidos, la protección tritilo puede inhibir eficazmente la racemización durante la reacción, lo que la hace especialmente adecuada para péptidos que contienen histidina.
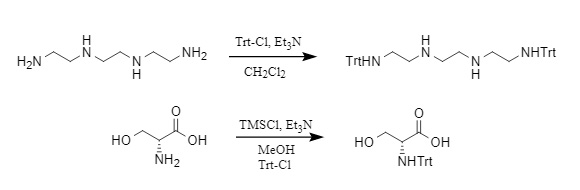
El grupo protector Trt se introduce típicamente utilizando Trt-Cl en condiciones alcalinas, que es uno de los métodos más comunes. Otros métodos incluyen el uso de Trt-OH (alcohol tritílico) y Ac₂O en condiciones ácidas, o el uso de una combinación de TMSCl/Et₃N/Trt-Cl para introducir el grupo tritilo. Se muestran ejemplos en la Figura 2.
Figura 2 Ejemplo de introducción de tritilo
3. Método de eliminación
Aunque el grupo tritilo es relativamente estable, es un grupo sensible al ácido y se elimina fácilmente en diversas condiciones ácidas, como ácido clorhídrico, TFA y ácido acético. El grupo protector Boc también se elimina típicamente en condiciones ácidas, lo que permite una eliminación selectiva basada en la sensibilidad ácida de diferentes grupos protectores. Por ejemplo, Trt se puede eliminar fácilmente en una solución acuosa de HOAc al 50%, mientras que el grupo protector Boc permanece inalterado. Sieber et al. investigaron la estabilidad de los grupos protectores Trt y Boc en Trt-His(Trt)-Lys(Boc)-OMe (Figura 3) y encontraron que el grupo protector Trt en la cadena lateral de histidina es más estable que el grupo protector Trt en el grupo α-amino. Además, en un sistema 1 N HCl/ácido acético, el grupo protector Boc se elimina mientras que el grupo protector Trt en la cadena lateral de histidina permanece inalterado.
![Estudio sobre la estabilidad de los grupos protectores Trt y Boc en Trt-His(Trt)-Lys(Boc)-OMe Estudio sobre la estabilidad de los grupos protectores Trt y Boc en Trt-His(Trt)-Lys(Boc)-OMe]()
Figura 3 Estudio sobre la estabilidad de los grupos protectores Trt y Boc en Trt-His(Trt)-Lys(Boc)-OMe
Además, el grupo tritilo puede desprotegerse mediante los siguientes métodos:
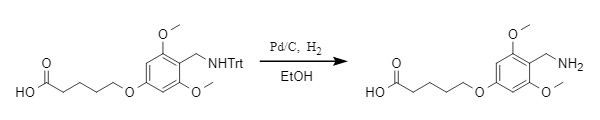
1. Eliminación reductora: El grupo protector Trt puede eliminarse en condiciones reductoras, como la hidrogenación con Pd/C (véase la figura siguiente) y Na/NH3(l). En la hidrogenación catalítica, la velocidad de eliminación de Trt es significativamente menor que la de otros grupos protectores, como O-Bn y N-Cbz, lo que permite una eliminación selectiva basada en las características de los diferentes grupos protectores.
Figura 4 Hidrogenación catalítica de Pd/C para la eliminación de Trt
Además, el equipo de Chandrasekhar desarrolló un método para convertir la protección N-Trt en protección N-Boc en un solo paso. Mediante la acción de Pd(OH)₂/C y PMHS (polimetilhidrogenosiloxano), los compuestos N-Boc pueden sintetizarse en un solo paso con alta eficiencia y una amplia gama de sustratos.
Figura 5 Síntesis de un solo paso de la protección N-Boc
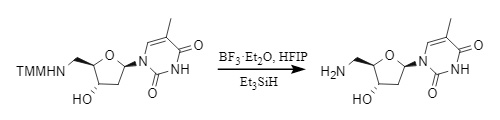
2. Eliminación de ácidos de Lewis: Para sustratos sensibles a los ácidos protónicos, los ácidos de Lewis como ZnBr₂, BF₃·Et₂O, etc., son reactivos de desprotección eficaces. Por ejemplo, en el sistema BF₃·Et₂O/Me₃SiH/HFIP (hexafluoroisopropanol), es posible una eliminación rápida y eficiente:
Figura 6 Desmetilación del MMT mediante ácido de Lewis
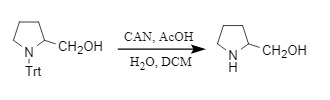
3. Eliminación del reactivo CAN (nitrato de amonio y cerio): El reactivo CAN puede eliminar Trt mediante transferencia de un solo electrón, convirtiendo así el grupo amino en un anión amino. En el proceso, se requiere ácido acético y otros ácidos para proporcionar protones de hidrógeno y obtener aminas libres; de lo contrario, las materias primas se regenerarán.
Figura 7: Eliminación de Trt mediante el reactivo CAN
Los grupos protectores tritilo se usan ampliamente en la síntesis de nucleósidos y péptidos debido a su facilidad de introducción y remoción. Si bien el impedimento estérico les proporciona buena selectividad, también limita ciertas reacciones: la mayoría de los Trt-aminoácidos son difíciles de construir enlaces amida usando los métodos de anhídrido mixto o azida, y los ésteres de Trt-aminoácidos también son difíciles de hidrolizar debido a su significativo impedimento estérico.
Por lo tanto, después de obtener un profundo conocimiento de las características de varios grupos protectores, los investigadores pueden seleccionar la estrategia de protección más apropiada según las condiciones de reacción específicas y las características de la estructura molecular para sintetizar eficientemente los compuestos objetivo.
Referencias:
[1] Zhang Panpan, Zheng Tucai, Chen Sheng, et al. Avances en la aplicación de grupos protectores tritilo en síntesis orgánica [J]. Journal of Synthetic Chemistry, 2014, 2, 28-40.
[2] Ito, C.; Taguchi, K.; Matsumoto, K.; et al. Grupos trimetoxi tritilo como un potente sustituyente para profármacos análogos de citidina anticancerígenos[J]. J. Pharm. Sci., 2022, 111, 2201-2209.
[3] Sieber, P.; Riniker, B. Protección de funciones carboxamida por el residuo tritilo. Aplicación a la síntesis de péptidos[J]. Tetrahedron Lett., 1991, 32, 739-742.
[4] Krakowiak, KE; Bradshaw, JS Protección selectiva de las funciones amina primaria de tetraaminas lineales utilizando el grupo tritilo[J]. Synth. Commun., 1998, 28, 3451-3459.
[5] Baghery, S.; Zarei, M.; Behranvand, V.; et al. Aplicación de fracciones tritilo en procesos químicos: parte I[J]. J. Iran. Chem. Soc., 2020, 17, 2737-2843.
[6] Sieber, P.; Riniker, B. Protección de la histidina en la síntesis de péptidos: una reevaluación del grupo tritilo[J]. Tetrahedron Lett., 1987, 28, 6031-6034.
[7] Sharma, SK; Songster, MF; Castellino, FJ; et al. Aminación reductora con tritilamina como equivalente de amoníaco: preparación eficiente del ácido 5-[4-[(9-fluorenilmetiloxicarbonil)-amino]metil]-3,5-dimetoxifenoxi]valérico (PAL) para la síntesis de péptidos[J]. J. Org. Chem., 1993, 58, 4993-4996.
[8] Chandrasekhar, S.; Babu, BN; Reddy, CR Conversión en un solo paso de N-bencil, N-tritil y N-difenilmetil aminas a t-butil carbamatos usando polimetilhidrosiloxano[J]. Tetrahedron Lett., 2003, 44, 2057-2059.
[9] Bege, M.; Bereczki, L.; Herczegh, P.; et al. Un sistema de reactivos de tres componentes para la eliminación rápida y suave de grupos protectores O-, N- y S-tritilo[J]. Org. Biomol. Chem., 2016, 1–3.
[10] Pattanayak, S.; Sinha, S. Destritilación de aminas tritiladas mediada por nitrato de amonio cérico[J]. Tetrahedron Lett., 2011, 55, 34-37.