Este artículo presentará brevemente la serie ftaloilo de grupos protectores de amino.
1. Introducción
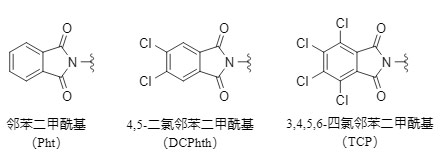
El ftaloílo y sus derivados son un tipo de grupos protectores de amino de uso común (véase la estructura en la figura a continuación, denominados colectivamente ftaloílo a continuación, y los grupos protectores específicos están representados por sus abreviaturas), que se utilizan ampliamente en la síntesis de moléculas orgánicas complejas, especialmente péptidos y azúcares.
Figura 1 Grupos protectores comunes del ácido ftálico
El ftaloílo se utiliza habitualmente para proteger aminas primarias. Puede permanecer estable en condiciones ácidas convencionales, hidrogenólisis catalítica y sistemas de reducción NH₃(l)/Na. En comparación con otros grupos protectores de acilo, el ftaloílo puede lograr la sustitución completa de los grupos amino, inhibiendo así eficazmente la racemización en la síntesis de péptidos. Sin embargo, es inestable en condiciones alcalinas y en presencia de nucleófilos fuertes, por lo que el hidrato de hidrazina se utiliza a menudo para la desprotección.
2. Método de introducción
1. Método del anhídrido ftálico
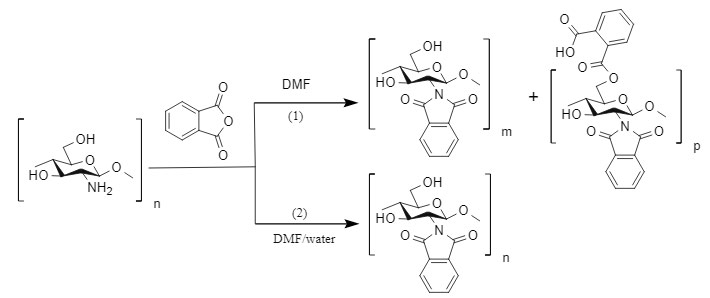
Kurita et al. utilizaron anhídrido ftálico en una solución de DMF con 5 % de agua a 120 °C para introducir el grupo protector Pht al proteger el grupo amino del quitosano, con un rendimiento superior al 80 %. En estas condiciones, el grupo amino puede protegerse selectivamente, sin afectar al grupo hidroxilo (ruta 2). Kurita et al. también descubrieron que, si la reacción se lleva a cabo en DMF puro, se obtendrá un subproducto con protección tanto del grupo amino como del hidroxilo (ruta 1).
Este método suele requerir una temperatura más alta. Si la molécula contiene múltiples grupos amino (coexisten aminas secundarias y primarias), es probable que se produzcan reacciones secundarias con aminas secundarias. Sin embargo, este método es relativamente sencillo de posprocesar y es adecuado para la producción industrial.
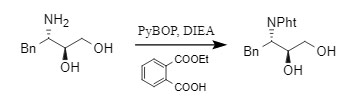
2. Método del ftalato de monoetilo
Aguilar et al. utilizaron ftalato de monoetilo en presencia de una base (como DIEA) y un reactivo de condensación, PyBOP, para promover la reacción de la amida, introduciendo así un grupo protector Pht.
Este método es relativamente engorroso y requiere mucho tiempo para reaccionar. Además, no es adecuado para la coexistencia de múltiples grupos amino.
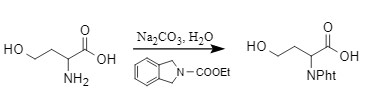
3. Método de la N-etoxicarbonilftalimida.
Jonghe et al. utilizaron N-etoxicarbonilftalimida para introducir el grupo protector Pht en condiciones alcalinas al proteger el
grupo
amino
. Este método es suave, económico y permite proteger selectivamente las aminas primarias en presencia de aminas secundarias. Actualmente, es un método de introducción más común.
Khalifa et al. desarrollaron un método para introducir eficientemente un grupo protector Pht mediante N-bencenosulfonilftalimida (preparada mediante la reacción de ftalimida y cloruro de bencenosulfonilo). Este método permite introducir Pht en condiciones de reflujo de acetonitrilo, con alto rendimiento y sin necesidad de base adicional, y es aplicable a diversas aminas aromáticas y alifáticas.
3. Método de eliminación
Es crucial elegir un método de eliminación adecuado, que no solo tenga una alta eficiencia de eliminación, sino que también garantice que otros grupos protectores no se vean afectados.
1. Método de hidrazinólisis: por lo general, el grupo protector Pht se elimina mediante hidrólisis de hidrazina. Generalmente, se puede eliminar por completo mediante reflujo en una solución alcohólica de hidrato de hidrazina. En estas condiciones, Cbz, Boc, Ts, Trt y otros grupos protectores no se ven afectados.
2. Método NaBH4/i-PrOH/AcOH: este método es un complemento del método de hidrólisis de hidrazina. Cuando el efecto de la hidrólisis de hidrazina no es bueno, esta condición se puede utilizar para eliminar bien el Pht.
3. Método de etilendiamina: el grupo tetracloroftaloílo (TCP) de esta serie se elimina selectivamente en presencia de etilendiamina, mientras que el grupo éster y el Pht no se ven afectados.
4. Estrategia de síntesis
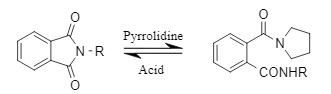
El grupo protector Pht puede inactivarse temporalmente para asegurar el desarrollo normal de otras reacciones, y posteriormente, la estrategia de "resurrección" puede emplearse en situaciones específicas. Dada la baja estabilidad del Pht en presencia de reactivos alcalinos y nucleófilos, puede reaccionar con tetrahidropirrol para obtener un derivado más estable. Una vez completadas otras reacciones, puede regenerarse en un grupo Pht en condiciones ácidas y continuar participando en reacciones posteriores.
Este artículo describe los métodos de introducción y eliminación del grupo protector amino - ftaloilo y su aplicación expandida en estrategias sintéticas, con la esperanza de proporcionar referencia e ideas para los trabajadores relacionados.
Referencias:
[1] Guo Yanhao, Hao Qinghui, Hao Siyuan, et al. Protección y desprotección de grupos amino en productos químicos [J]. Industria química y del carbón, 2022, 45, 106-112.
[2] Kurita, K.; ikeda, H.; Harata, M.; et al. Protección quimioselectiva de los grupos amino del quitosano mediante ftaloilación controlada: preparación fácil de un precursor útil para modificaciones químicas [J]. Biomacromolecules, 2002, 3.
[3] Aguilar, N.; Moyano, A.; Pericàs, MA; Riera, A. Síntesis general, catalítica y enantioselectiva de (S)-γ-[(S)-1-aminoalquil]-γ-lactonas[J]. J. Org. Chem. 1998, 63, 3560-3567.
[4] Jonghe, SD; Lamote, I.; Herdewijn. P; et, al. Síntesis de homoceramidas, nuevos análogos de ceramida y su falta de efecto en el crecimiento de neuronas hipocampales[J]. J. Org. Chem. 2002, 67, 988-996.
[5] Khalifa, A.; Giles, M.; Ali, HI; Mohamady, S. Síntesis libre de metales y catalizadores de ftalimidas 2-sustituidas usando 2-(arenesulfonil)ftalimida como reactivos clave[J]. Eur. J. Org. Chem. 2023, 26.
[6] Debenham, JS; Fraser-Reid, B. Tetracloroftaloilo como grupo protector de amina versátil [J]. J. Org. Chem. 1996, 61, 432-433.
[7] Astleford, B.; Weigel, LO "ALCANCE DE LA QUÍMICA DE LOS FTALIMIDO I. EXTENSIÓN DE LA UTILIDAD POR CONVERSIÓN AL GRUPO PROTECTOR OPCB." [J]. Tetrahedron Lett., 1991, 32, 3301-3304.