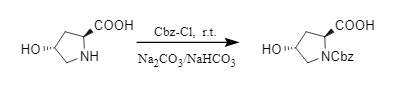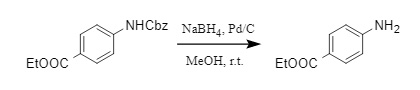1. Introducción
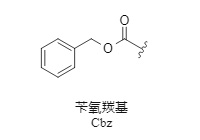
El Cbz es uno de los grupos protectores de amino más utilizados (1). Su ventaja es su fácil introducción y eliminación. Además, la introducción del grupo protector Cbz suele facilitar la cristalización del producto protegido y mejorar su estabilidad, lo que facilita su purificación por cristalización.
(1)
2. Método de introducción
1. Condiciones alcalinas:
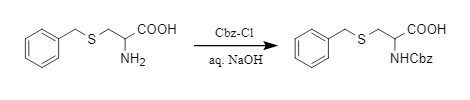
(1) Existen numerosos métodos para introducir grupos protectores Cbz. El método más común consiste en reaccionar con cloroformiato de bencilo (Cbz-Cl) en condiciones alcalinas para generar compuestos amino protegidos con N-Cbz (2). Además del Cbz-Cl, también se pueden utilizar ésteres activados como el carbonato de N-bencilsuccinimidilo (Cbz-Osu) y el carbonato de 4-nitrofenilbencilo (Cbz-ONB) como reactivos para introducir grupos benciloxicarbonilo.
(2)
(2) Al utilizar Cbz-Cl para introducir Cbz en condiciones alcalinas, el pH suele controlarse entre 8 y 10. Un pH demasiado bajo provocará la descomposición del Cbz-Cl, mientras que un pH demasiado alto puede provocar la racemización de aminoácidos. Por lo tanto, la base no solo actúa como un agente aglutinante de ácido para neutralizar el HCl generado en este proceso, sino que también mantiene la estabilidad del pH del sistema de reacción, lo cual es algo difícil en la producción a gran escala. El equipo de Abell desarrolló un sistema tampón de base mixta de Na₂CO₃: NaHCO₃ = 2:1, que puede mantener eficazmente el pH en el rango de 8 a 10 y es adecuado para la protección de Cbz de diversos aminoácidos quirales (3).
(3)
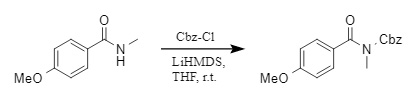
(3) Además, el grupo de Sureshbabu desarrolló un método conveniente para introducir grupos protectores de Cbz en el nitrógeno de amidas secundarias (4). En presencia de la base LiHMDS (bis(trimetilsilil)amida de litio), la amida secundaria reaccionó con Cbz-Cl para lograr la protección N-Cbz.
(4)
2. Condiciones no alcalinas:
Los grupos protectores Cbz también pueden utilizarse para proteger de forma suave y eficiente el N-Cbz en condiciones no alcalinas.
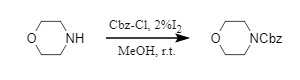
(1) Cbz-Cl/I₂/MeOH:
El equipo de Varala desarrolló un método catalizado por yodo para la introducción eficiente de grupos protectores Cbz. Una cantidad catalítica de yodo actúa como un ácido de Lewis, introduciendo de forma suave y eficiente grupos protectores Cbz en compuestos amínicos con diferencias significativas en estructura y propiedades electrónicas (5).
(5)
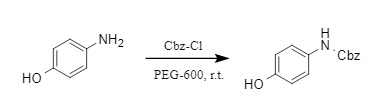
(2) Cbz-Cl/PEG-600:
El equipo del profesor Huang Haihong desarrolló un método eficiente, ecológico y químicamente selectivo para la introducción de grupos protectores de Cbz (6). Este método utiliza PEG-600 ecológico y de baja toxicidad como medio de reacción. Las aminas alifáticas y aromáticas reaccionan con Cbz-Cl para obtener los correspondientes derivados de N-Cbz con altos rendimientos.
(6)
3. Método de eliminación
Existen varios métodos para eliminar el grupo protector Cbz, siendo la hidrogenólisis catalítica el más común. Cuando el sustrato contiene otros grupos sensibles, se puede considerar la desprotección selectiva en condiciones ácidas, alcalinas u otras.
1. Hidrogenólisis catalítica:
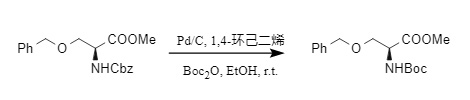
La hidrogenólisis catalítica incluye la hidrogenación catalítica y la hidrogenación por transferencia, ambas adecuadas para la eliminación de Cbz. Normalmente, cuando hay suficiente fuente de hidrógeno, se generará dióxido de carbono y tolueno; si la fuente de hidrógeno es insuficiente, se producirá una reacción secundaria que generará aminas terciarias protegidas con N-bencilo. Si Boc₂O también está presente en el sistema, la protección N-Cbz se puede convertir en derivados N-Boc en un solo paso, y los grupos funcionales fácilmente reducibles, como el éter bencílico, no se verán afectados (7).
(7)
Además, la combinación de Pd-C/NaBH₄/MeOH también es un método conveniente para la eliminación de Cbz (8). Este método permite eliminar Cbz de forma rápida y sencilla mediante la generación de hidrógeno in situ y presenta buena compatibilidad con numerosos grupos protectores convencionales.
(8)
2. Condiciones ácidas:
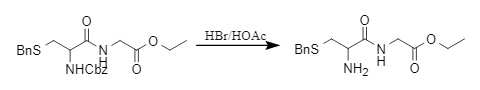
El grupo protector Cbz también se puede eliminar fácilmente en condiciones ácidas. El HBr/HOAc es un sistema de eliminación de Cbz comúnmente utilizado (9). La tasa de desprotección aumenta con el aumento de la concentración de HBr.
(9)
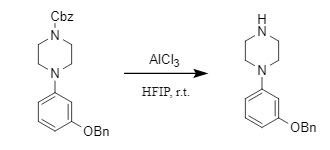
De forma similar, los ácidos de Lewis también pueden utilizarse para eliminar la protección N-Cbz. El sistema AlCl₃/HFIP (hexafluoroisopropanol) puede eliminar selectivamente la protección Cbz de forma suave y segura en presencia de grupos sensibles como grupos nitro, dobles enlaces y grupos bencilo, y presenta una buena aplicabilidad en sustratos (10).
(10)
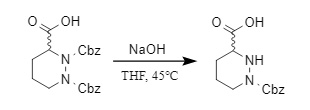
3. Condiciones alcalinas:
En ciertas condiciones específicas, las condiciones alcalinas también pueden lograr la eliminación de grupos protectores Cbz. Por ejemplo, en compuestos de ácido diazinoico protegidos con N,N'-bis-Cbz, un grupo protector Cbz puede eliminarse selectivamente en condiciones alcalinas (11). Además, en una solución de hidróxido de sodio a alta concentración, el grupo protector Cbz en una posición específica del intermediario de kanamicina A, como la posición N-3', puede eliminarse selectivamente.
(11)
4. Otras condiciones:
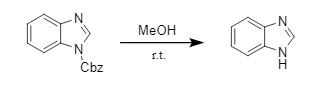
Además de los métodos de desprotección mencionados anteriormente, existen muchos otros métodos que pueden utilizarse para eliminar la protección N-Cbz en condiciones específicas. Por ejemplo, se pueden utilizar alcoholes inferiores (metanol, etanol, etc.) para eliminar los grupos protectores N-Cbz en compuestos de imidazol y pirazol (12). Los reactivos organometálicos, como el sistema n-Bu₃SnH/AIBN, pueden eliminar selectivamente los grupos protectores N-Cbz en amidas y anillos heteroaromáticos nitrogenados, mientras que la protección Cbz en aminas alifáticas no se ve afectada. Estos métodos pueden complementar los métodos convencionales de eliminación de Cbz y no se describirán en detalle en este artículo.
(12)
En resumen, cada uno de los métodos de eliminación de Cbz mencionados anteriormente tiene sus propias ventajas y desventajas, así como escenarios adecuados. En reacciones de síntesis orgánica complejas, la introducción y eliminación de grupos protectores requiere la selección de estrategias sintéticas apropiadas basadas en las características estructurales de los sustratos de reacción específicos.
Referencias:
[1] Xu Qiuxia. Investigación sobre la síntesis química del glutatión [D]. Universidad de Donghua, 2010.
[2] Pehere, AD; Abell, AD Un procedimiento mejorado a gran escala para la preparación de aminoácidos N-Cbz [J]. Tetrahedron Lett., 2011, 52, 1493-1494.
[3] Sureshbabu, P.; Azeez, S.; Kandasamy, J., et al. Síntesis de amidas de N-Cbz y sus aplicaciones en las reacciones de transamidación a temperatura ambiente [J]. Asian J. Org. Química, 2022, 11.
[4] Varala, R.; Enugala, R.; Adapa, SR. Protección eficiente de aminas mediante N-Cbz catalizada por yodo molecular [J]. J. Iran. Química Soc., 2007, 4, 370-374.
[5] Zhang, CL; Zhang, DF; Huang, HH; et al. Un protocolo sencillo para la protección de aminas mediante N-Cbz en PEG-600 [J]. Chinese Chemical Letters, 2012, 23, 789-792.
[6] Cameron, M.; Wilson, RD La formación inesperada de aminas terciarias N-benciladas a partir de sus precursores protegidos con CBZ correspondientes [J]. APPL CATAL A-GEN, 2000, 203, 307-310.
[7] Bajwa, JS Transformación en un solo recipiente de carbamatos de bencilo en carbamatos de t-butilo[J]. Tetrahedron Lett. 1992, 33, 2955-2956.
[8] Sultane, PR; Mete, TB; Bhat, RG Un protocolo conveniente para la desprotección de grupos N-benciloxicarbonilo (Cbz) y éster bencílico[J]. Tetrahedron Lett., 2015, 56, 2067-2070.
[9] Vinayagam, V.; Sadhukhan, SK; Kumar, TVH; et al. Método suave para la desprotección del grupo N-benciloxicarbonilo (N Cbz) mediante la combinación de AlCl3 y HFIP[J]. J. Org. Chem., 2024, 89, 5665-5674.
[10] Papadaki, E.; Georgiadis, D.;
[11] Chen, GH; Pan, P.; Li, ZJ; et al. Desprotección selectiva del grupo protector de amina Cbz para la síntesis fácil de dímeros de kanamicina A unidos en la posición N-300[J]. Tetrahedron, 2009, 65, 5922-5927.
[12] Song, GQ; Huang, XF; Yang, B.; et al. Fácil eliminación del grupo protector N-carboxibencilo (Cbz) por alcohol bajo en carbono[J]. Lett. Org. Chem., 2016, 13, 177-180.
[13] Bennasar, ML; Roca, T.; Padullés, A. Escisión radical quimioselectiva de compuestos nitrogenados protegidos con Cbz[J]. Org. Lett., 2003, 5, 569-572.