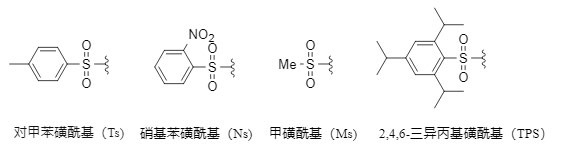
Cabe destacar que los diferentes grupos protectores tienen diferentes condiciones de tolerancia. Entre todos los grupos protectores amino, el grupo sulfonilo (la Figura 1 muestra varios grupos protectores sulfonilo comunes) es uno de los más estables. Su método de introducción generalmente consiste en hacer reaccionar la amina con el cloruro de sulfonilo correspondiente en un disolvente inerte en condiciones alcalinas. Presenta las siguientes ventajas:
(1) Es compatible con diversas condiciones de reacción y no se ve afectado por el tratamiento con bases fuertes, la hidrogenación ni otras condiciones. Además, tras la introducción del grupo sulfonilo, el producto puede cristalizarse fácilmente, lo cual facilita su adquisición y purificación.
(2) La introducción del grupo sulfonilo hace que el enlace NH sea más activo, de modo que la reacción de N-alquilación y la formación de CN catalizada por metales de transición pueden ocurrir fácilmente.
Figura 1. Grupos protectores de sulfonilo comunes
De igual manera, la mayor estabilidad del grupo sulfonilo también hace que sus condiciones de desprotección sean más rigurosas. La hidrólisis ácida suele realizarse en condiciones severas, como el calentamiento con ácido sulfúrico concentrado; un método más suave es la escisión reductora, como Na/NH₃(l), Mg/MeOH y otros sistemas. Sin embargo, este método se limita a sustratos que contienen grupos fácilmente reducibles, como aldehídos, carbonilos de cetonas y grupos nitro, y es propenso a reacciones secundarias.
Este artículo presenta un método basado en ácido trifluorometanosulfónico estequiométrico para eliminar eficazmente la protección de los grupos sulfonilo de aminas aromáticas y aplicaciones relacionadas.
(1) Excelente universalidad del sustrato:
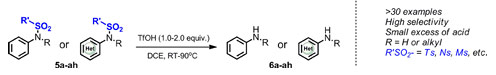
A temperatura ambiente o en condiciones de calentamiento, el ácido trifluorometanosulfónico puede eliminar eficazmente los grupos protectores de sustratos de sulfonamidas aromáticas/heteroaromáticas no sustituidas y N-sustituidas para obtener las aminas aromáticas correspondientes con altos rendimientos. Si bien la reacción se lleva a cabo en condiciones ácidas, tolera sustratos que contienen grupos ciano, imida y éster, así como sustratos básicos como la piridina y la quinolina. Este método es aplicable a grupos protectores como p-toluenosulfonilo (Ts), nitrobencenosulfonilo (Ns), metilsulfonilo (Ms) y triisopropilsulfonilo (TPS) (Figura 2).
Figura 2 Reacción de desprotección de sulfonamida promovida por ácido trifluorometanosulfónico
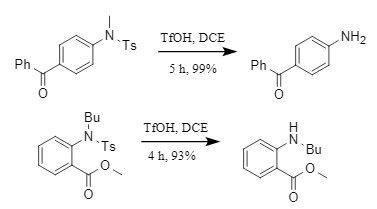
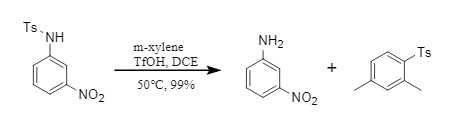
① Sustratos neutros y deficientes en electrones: El enlace NS en la sulfonamida se rompe fácilmente, logrando una eliminación eficiente del grupo sulfonilo (Figura 3);
Figura 3 Reacción de desprotección de sustratos deficientes en electrones
2 Sustratos ricos en electrones: se produce un reordenamiento de Fries (migración intramolecular de sulfonilo) para generar una serie de compuestos de sulfona (Figura 4).
Figura 4 Reacción de desprotección de sustratos ricos en electrones
(2) Eliminación selectiva del grupo protector Ts:
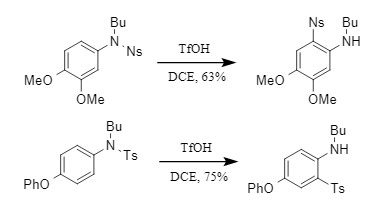
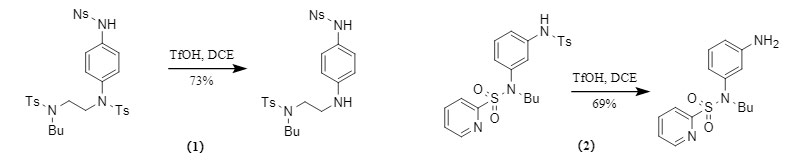
Normalmente, es difícil eliminar el grupo protector Ts. Sin embargo, el equipo de Orentas descubrió en el experimento que, en presencia de TfOH, Ts puede eliminarse selectivamente sin afectar a otros grupos protectores de sulfonilo (Figura 5).
① Los grupos protectores Ts en aminas aromáticas se eliminan preferentemente: Existen diferencias en la estabilidad de los grupos protectores Ts en diferentes posiciones, entre las cuales los grupos protectores Ts en aminas aromáticas son más fáciles de eliminar;
② Excelente selectividad: Cuando Ts coexiste con otros grupos protectores de sulfonilo como Ns y Ms, el grupo protector Ts aún puede eliminarse selectivamente. Incluso cuando el piridina-2-sulfonilo, muy inestable, coexiste con Ts, el grupo protector Ts aún se elimina preferentemente.
Figura 5. Eliminación selectiva del grupo protector Ts
(3) Otras aplicaciones:
① Transferencia de sulfonilo intermolecular: en presencia de compuestos aromáticos ricos en electrones, los sustratos de sulfonamida deficientes en electrones pueden experimentar sulfonilación FC (aquí se refiere a transferencia de sulfonilo intermolecular) mientras se desprotegen para generar compuestos de sulfona (Figura 6).
Figura 6. Migración intermolecular de grupos sulfonilo
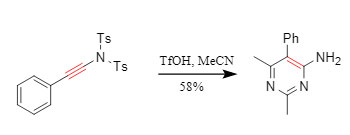
② Ciclación en un solo paso: Los sustratos de sulfonamida conjugada pueden experimentar una reacción de cicloadición [2+2+2] mientras se desprotegen. Por ejemplo, el acetonitrilo y el acetonitrilo experimentan una reacción de ciclización de nitrilo en presencia de TfOH para obtener aminopirimidinas en un solo paso (Figura 7).
Figura 7. Reacción de ciclización que involucra sulfonamida.
Este artículo presenta nuevos métodos para eliminar grupos sulfonilo y sus aplicaciones expandidas, con la esperanza de proporcionar ayuda e ideas para los investigadores.
Referencias:
[1] Orentas, E.; Javorskis, T. Desprotección quimioselectiva de sulfonamidas en condiciones ácidas: alcance, migración del grupo sulfonilo y aplicaciones sintéticas [J]. J. Org. Chem., 2017, 82, 13423-13439.
[2] Kisla, MM; Kul, P.; Kus, C.; et al. Incorporación de grupos protectores en química orgánica: una minirevisión [J]. Curr. Org. Synth., 2023, 20, 491-503.
[3] Guo Yanhao, Hao Qinghui, Hao Siyuan, et al. Protección y desprotección de grupos amino en productos químicos [J]. Industria del carbón y química, 2022, 45, 106-112.