En respuesta a los problemas antes mencionados, el equipo de Yao Zhujun en la Universidad de Nanjing desarrolló un reactor molecular inmovilizado (RMMR) basado en el mecanismo de transferencia de acilo de los ribosomas.
Introducción al RMMR:
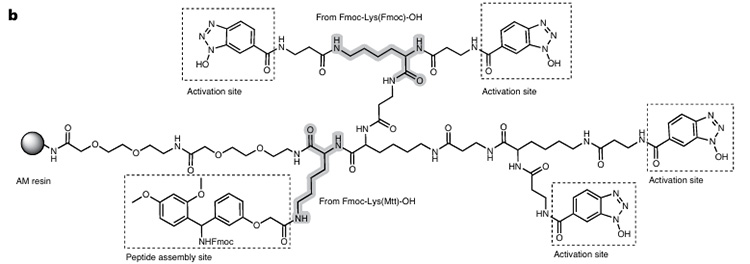
La resina RMMR se basa en la resina de amida de Rink, con sitios de activación dendríticos dispersos construidos mediante derivados de Fmoc-Lys, y finalmente fijados a la resina AM (Figura 1). Su capacidad de hinchamiento es comparable a la de las resinas comerciales y presenta buena estabilidad sin degradación durante 6 meses.
Figura 1. Composición de RMMR
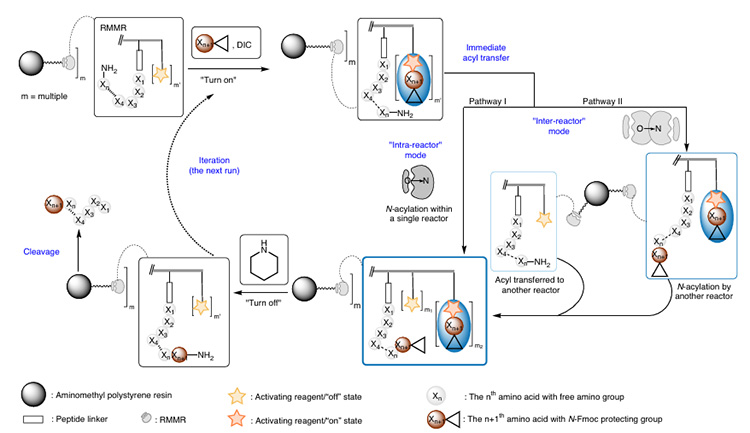
Este reactor conecta cuatro sitios de activación de carboxilo (véase la figura 2) y un sitio de síntesis de péptidos a la resina. En presencia de DIC y aminoácidos N-Fmoc, se forman múltiples intermediarios éster activos, lo que promueve una rápida transferencia de acilo O→N intramolecular o intermolecular entre el grupo amino N-terminal y los intermediarios de activación adyacentes (solo se acopla un grupo oxiacilo), mejorando así la eficiencia de síntesis de péptidos con impedimento estérico. Finalmente, el tratamiento con piperidina elimina simultáneamente el grupo protector Fmoc y regenera los ésteres activos no reaccionados. Su mecanismo de acción se muestra en la figura 3.
Figura 2. Activadores activos universales y sus derivados
Figura 3. Mecanismo de acción de los RMMR
Aplicaciones de RMMR:
1. Síntesis convencional de péptidos
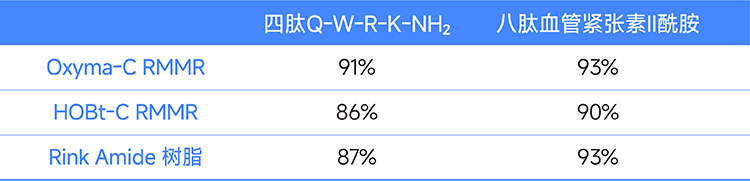
. En la síntesis convencional de péptidos, se sintetizaron el tetrapéptido QWRK-NH2 y el octapéptido angiotensina II amida utilizando resina RMMA con Oxyma-C y HOBt-C como sitios activos y resina Rink Amide comercial, respectivamente. Los resultados se comparan en la tabla siguiente.
Tabla 1. Comparación de resultados de tetrapéptidos y octapéptidos sintetizados con diferentes resinas.
Nota: Los valores de la tabla representan la pureza del producto crudo.
Los resultados experimentales muestran que los péptidos sintetizados con resina RMMR presentan una calidad comparable a la de los sintetizados con resina Rink Amide comercial. Además, la pureza del producto crudo obtenido mediante síntesis manual con resina Oxyma-C RMMR es del 97%, mientras que en la síntesis automatizada es del 94%, lo que demuestra resultados similares entre ambos métodos.
2. Síntesis de péptidos con impedimento estérico
(1) Síntesis de péptidos N-metilados.
En la síntesis de péptidos que contienen aminoácidos N-metilados, la resina RMMR mejora significativamente la eficiencia de condensación, alcanzando una pureza del producto de hasta el 98%, mientras que la pureza de los productos obtenidos con resina Rink Amide suele ser inferior al 20%. Algunos ejemplos se muestran en la Figura 4.
Figura 4. Síntesis de péptidos N-metilados utilizando diferentes resinas.
(2) Síntesis de péptidos α,α-disustituidos:
La resina RMMR también presenta una excelente capacidad sintética para la síntesis de péptidos que contienen aminoácidos α,α-disustituidos (como Aib, ácido α-aminoisobutírico). Para secuencias con dos aminoácidos α,α-disustituidos consecutivos (como se muestra en la Figura 5), la pureza puede superar el 90 %. En cambio, la resina Rink Amide comercial dificulta la síntesis eficaz de los péptidos correspondientes.
Figura 5. Síntesis de péptidos α,α-disustituidos continuos utilizando diferentes resinas.
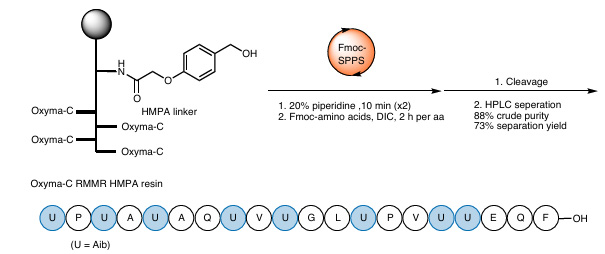
(3) Síntesis de análogos moleculares complejos de alamitecina F
Figura 6 Síntesis de análogos de alameticina F
Para verificar aún más la aplicabilidad de las resinas RMMR en estructuras complejas, el equipo sintetizó un análogo de alameticina F con ocho residuos de Aib utilizando la resina RMMR Oxyma-C. Los resultados experimentales mostraron que las resinas RMMR son igualmente eficientes para péptidos complejos con impedimento estérico: la pureza del producto crudo obtenido alcanzó el 88 % y el rendimiento de separación el 73 %.
Estos experimentos demuestran que las resinas RMMR, mediante su mecanismo de transferencia de acilo inmovilizado, superan las limitaciones de la síntesis en fase sólida tradicional en la preparación de péptidos con impedimento estérico, mejorando significativamente la eficiencia de condensación.
Conclusión general:
La serie de resinas RMMR ofrece una solución eficiente y fiable para la síntesis de péptidos con impedimento estérico y potencial farmacéutico, imitando el mecanismo de transferencia de acilo de los ribosomas. Destaca especialmente en la introducción de aminoácidos N-metilados y α,α-disustituidos. Además, la síntesis de aminoácidos complejos con esta serie de resinas solo requiere aminoácidos Fmoc y reactivos DIC disponibles comercialmente, y es compatible tanto con la síntesis manual como con la automatizada, lo que demuestra su amplio potencial de aplicación.
Introducción de la empresa:
Tras 22 años de esfuerzos constantes y una amplia trayectoria, Haofan Biotech ha continuado impulsando el sector global de reactivos para la síntesis de péptidos, consolidándose como una empresa líder con una extensa gama de productos personalizados y ventajas significativas en la producción a gran escala, lo que le permite satisfacer las necesidades específicas de diversos clientes. Invitamos cordialmente a los clientes interesados en este producto a contactarnos para obtener más información y explorar oportunidades de colaboración.
Referencias:
[1] Wei, S.; Zhang, X.; Yao, Z., et al. Immobilized acy-transfer molecular reactors enable the solid-phase synthesis of sterically legacyed peptides[J]. Nat. Chem. 2025, 17, 1596−1606.