I. Antecedentes Introducción:
En los últimos años, la introducción de técnicas de síntesis asistida por microondas y de síntesis de flujo ha mejorado aún más la eficiencia y el rendimiento de la síntesis en fase sólida. Sin embargo, estas técnicas suelen requerir equipos costosos y altamente especializados, lo que limita su adopción generalizada en los laboratorios habituales. Además, HATU, el reactivo activador ampliamente utilizado en la síntesis de Fmoc en fase sólida, presenta problemas de estabilidad térmica y seguridad.
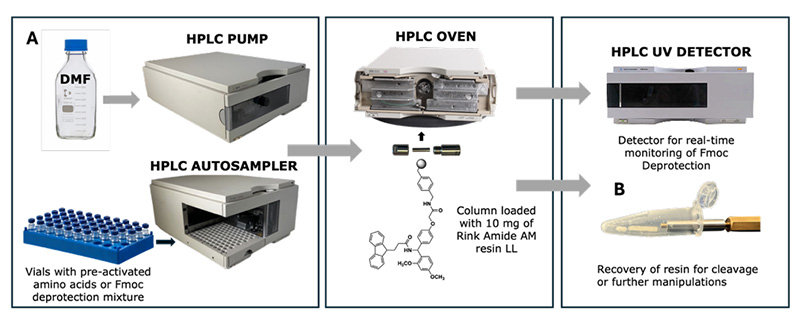
Por ello, el equipo de Nicolas Winssinger en la Universidad de Ginebra (Suiza) utilizó un sistema de cromatografía líquida de propósito general, modificándolo para técnicas de química de flujo y logrando la transformación de un cromatógrafo líquido de alta resolución (HPLC) a un sintetizador de péptidos.
II. Método de fase líquida:
La HPLC es una técnica de separación y análisis de uso común. Las muestras se separan en sus componentes mediante una columna cromatográfica para determinar su pureza. Este equipo empleó de forma innovadora una precolumna de guarda con 10 mg de resina como reactor de microflujo, con un fundido interno de 2 μm para evitar la pérdida de resina. Simultáneamente, se empleó un detector DAD (que detecta los subproductos de la desprotección de Fmoc) para obtener información en tiempo real sobre los resultados de la síntesis.
Este esquema utiliza TBEC (1-terc-butil-3-etilcarbodiimida)/Oxyma (cianoacetato de 2-oxima de etilo) como sistema de activación, lo que elimina la necesidad de añadir álcali y de preactivar, simplificando el proceso y haciéndolo más seguro y ecológico.
Con base en el equipo y el sistema de activación mencionados, para explorar las condiciones de síntesis, se utilizó el pentámero de fenilalanina como modelo, y las condiciones se optimizaron en el sistema de HPLC modificado. Los resultados experimentales mostraron que las condiciones optimizadas sintetizaron con éxito el pentapéptido objetivo, logrando una pureza del producto crudo superior al 93 % y una pureza en un solo paso superior al 99 %.
El método específico es el siguiente:
| Modelo de instrumento |
Agilent 1260 Infinity |
| Volumen del muestreador automático |
100 μL |
Temperatura de la columna |
80℃ |
| columna cromatográfica |
Columna de gel de sílice C18 / Columna de cromatografía Hypersil Gold C18 |
Pilar protector |
Relleno de resina (20 x 2 mm) |
| detector |
Detector DAD |
Longitud de onda de detección |
360 nm |
| Caudal |
1,0 ml/min |
fase móvil |
Fase móvil A: Solución de éster activado |
| Proceso de lavado |
Hora/minuto |
0 |
0.1 |
1.5 |
2.0 |
| Fase móvil A |
100 |
100 |
100 |
100 |
III. Procedimientos operativos:
Todo el proceso de síntesis incluye las siguientes etapas:
1. Pesaje y carga de resina: Pese 10 mg de resina (como resina Rink Amide) y llénela en la columna protectora vacía, luego séllela y fíjela.
2. Hinchamiento de resina: Sumerja la columna protectora cargada con resina en diclorometano y deje que se hinche durante 3-5 minutos.
3. Instalación: Ajuste la temperatura del horno de la columna a 80 ℃ e instale la columna protectora en el soporte correspondiente. 4.
Preparación de la solución de reactivo:
Solución de muestra: Prepare 0,6 M de aminoácido Fmoc, TBEC y solución de Oxyma NMP, y mézclelos en volúmenes iguales para obtener una solución 0,2 M.
Solución de desprotección: Agregue 20% de piperidina a DMF y transfiéralo a un vial de muestreador automático para su uso posterior.
5. Programación de la secuencia de inyección: Configure el instrumento para inyectar alternativamente la solución de derivado de aminoácido activado (para acoplamiento) y la solución de DMF de piperidina al 20% (para desprotección). Además, la desprotección debe realizarse dos veces consecutivas antes del inicio de la síntesis para asegurar la eliminación completa del grupo Fmoc inicial.
6. Lisis y desprotección de la resina: Sumerja la precolumna en diclorometano para eliminar el DMF residual; luego retire la resina y sumérjala en una solución de TFA (TFA/triisopropilsilano TIS/H₂O = 95:2,5:2,5) durante 3 horas para lograr la disociación y desprotección completas. Para secuencias específicas que contienen cisteína, metionina, etc., se puede utilizar un tampón de lisis mixto de TFA/1,2-etilenditiol EDT/TIS/H₂O = 90:5:2,5:2,5.
7. Procesamiento del producto: Separe la resina para precipitar el péptido crudo para una purificación adicional.
IV. Factores influyentes:
Para aminoácidos racémicos como la histidina y algunos aminoácidos especiales, el tiempo de preactivación tiene un impacto significativo en su eficiencia de acoplamiento. En la síntesis de 20 péptidos, el equipo comparó la eficiencia de acoplamiento de ésteres activos recién preparados con aquellos preactivados durante 24 horas, encontrando que Fmoc-Arg(pbf)-OH y Fmoc-His(Trt)-OH exhibieron una eficiencia de acoplamiento relativamente baja después de una activación prolongada.
Para investigar más a fondo el efecto del tiempo de preactivación en la eficiencia de acoplamiento, se sintetizaron tripéptidos FRF utilizando Fmoc-Arg(pbf)-OH como materia prima, con tiempos de preactivación de 15 minutos y 24 horas, respectivamente. Los resultados mostraron que la eficiencia de acoplamiento disminuyó significativamente después de 24 horas de preactivación, atribuida a la ciclización intramolecular de Fmoc-Arg(pbf)-OH después de la activación, lo que reduce su reactividad. Experimentos repetidos verificaron que la solución de activación ideal debe usarse dentro de las 4 horas posteriores a la preparación.
V. Isomerización diferencial:
La isomerización durante la síntesis de péptidos puede afectar la pureza estereoquímica y alterar la actividad biológica. Para evaluar el grado de racemización en estas condiciones sintéticas, el equipo empleó un método de síntesis en fase líquida para investigar aminoácidos fácilmente racemables, como la prolina, la cisteína y la serina, y no se observó racemización en ninguno de ellos. Al comparar los efectos de acoplamiento del sistema TBEC/Oxyma y el sistema HATU/DIPEA, el equipo utilizó His (Trt) recién activada para la reacción. Los experimentos revelaron que el primero presentó una epimerización del 3,6 %, mientras que el segundo mostró una tasa de isomerización del 4,8 %.
VI. Aplicaciones prácticas:
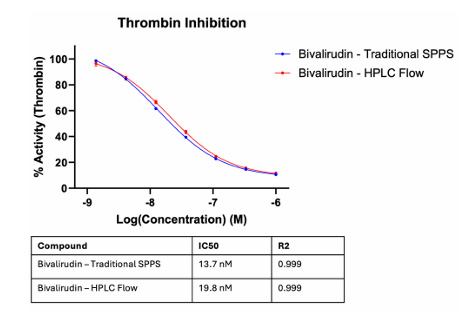
El equipo sintetizó con éxito péptidos como el GLP-1 (30 aminoácidos) y la bivalirudina (20 aminoácidos), con un rendimiento del 52,1 % para el GLP-1 sintetizado mediante una columna de síntesis con 10 mg de resina. En cuanto a la bioactividad, la bivalirudina cruda sintetizada por HPLC y la bivalirudina pura sintetizada por SPPS convencional mostraron una bioactividad similar (véase la figura siguiente).
Figura 5
VII. Ventajas y limitaciones:
El sistema HPLC fácilmente disponible, aplicado a la síntesis fluida automatizada de péptidos, tiene las siguientes ventajas y desventajas:
1. Ventajas:
- Transformar el HPLC estándar en una plataforma sintética multifuncional;
- Utilice un sistema de activación TBEC/Oxyma más seguro;
- Puede obtener péptidos de alta pureza y monitorear la reacción en tiempo real;
- Presenta buena estereoselectividad y puede sintetizar polipéptidos con secuencias complejas;
- Es económico, utiliza equipos HPLC ampliamente disponibles, reduce los costos de los equipos y puede beneficiar a más laboratorios;
- Ofrece alta flexibilidad y puede utilizarse para la síntesis de péptidos/oligonucleótidos. También permite alternar entre los modos de síntesis y purificación cambiando la columna.
2. Limitaciones:
- No puede sintetizar ciertas secuencias complejas;
- Las velocidades de reacción difieren entre diferentes aminoácidos o cadenas peptídicas, lo que requiere una mayor optimización.
- El volumen de síntesis es pequeño y sólo es adecuado para la síntesis a nivel de microgramos a miligramos.
VIII. Conclusión general:
Este estudio proporciona una plataforma de síntesis de péptidos sencilla, segura y económica que permite la reacción y la detección simultáneas mediante un sistema HPLC convencional. Este enfoque no solo mantiene la integridad estereoquímica del producto, sino que también permite la síntesis de fragmentos de secuencia complejos y biológicamente activos, lo que contribuye a una mayor adopción de las técnicas de síntesis de flujo en más laboratorios.
Acerca de Highfine Biotech:
Suzhou Highfine Biotech Co., Ltd. (Código bursátil: 301393.SZ), fundada en 2003 y con sede en la Zona de Alta Tecnología de Suzhou, es una empresa nacional de alta tecnología que proporciona materias primas especializadas a empresas globales de I+D y fabricación farmacéutica. Sus productos se utilizan principalmente en la síntesis de péptidos, nucleótidos y fármacos, abarcando una amplia gama que incluye agentes condensantes para la formación de enlaces amida especializados, agentes protectores, enlazadores, agentes de reticulación de proteínas para conjugados anticuerpo-fármaco, bloques de construcción moleculares, liposomas y reactivos de fósforo. Actualmente, ha desarrollado y producido más de 1500 productos.
Tras 22 años de incansable esfuerzo y acumulación, Highfine Biotech ha profundizado continuamente su experiencia en el campo global de reactivos para la síntesis de péptidos y se ha convertido en una empresa líder con una amplia gama de productos personalizados y ventajas significativas en la producción a gran escala, capaz de satisfacer las necesidades específicas de diversos clientes. Invitamos cordialmente a los clientes interesados en nuestros productos a contactarnos para obtener más información y analizar oportunidades de colaboración.
Referencias:
[1] Romanens, P.; Barluenga, MD; Winssinger, N., et al. Péptidos disponibles: Síntesis de flujo automatizada con HPLC estándar [J]. ChemRxiv. 2025.