Aproximadamente un tercio de los 200 medicamentos más vendidos en el mundo en 2019 contienen enlaces amida [2,3]. El desarrollo de métodos eficientes de síntesis de amidas ha sido durante mucho tiempo uno de los principales objetivos de la química sintética. El método de síntesis de amidas, ecológico y respetuoso con el medio ambiente, ha sido identificado como un área de investigación clave por el Instituto de Química Verde de la Sociedad Química Estadounidense y se está desarrollando continuamente [4].
Al mismo tiempo, la formación de enlaces amida es una de las reacciones más básicas y centrales en el campo de la síntesis de péptidos y proteínas. Después de una investigación a largo plazo, los científicos han desarrollado muchos métodos para construir enlaces amida, como el anhídrido mixto, el método de acilazida, el método del agente de condensación y otros métodos, pero el más utilizado sigue siendo el método de síntesis de amida mediada por el agente de condensación. Los agentes de condensación tradicionales todavía tienen algunos defectos en la eficiencia de la reacción, la pureza óptica, el impedimento estérico, la estabilidad, la separación, etc. Además, la baja economía atómica de la síntesis de péptidos en fase sólida ha planteado grandes desafíos para el desarrollo sostenible. Por lo tanto, desarrollar un reactivo de condensación eficiente, simple y ópticamente puro es un problema importante que aqueja a los investigadores.
En los últimos años, el equipo del profesor Zhao Junfeng se ha comprometido a resolver los difíciles problemas en el campo de la síntesis química de péptidos y proteínas mediante el desarrollo de nuevos reactivos y nuevas reacciones en torno a la formación de enlaces amida. Gracias a incansables esfuerzos, desarrollaron un nuevo reactivo de condensación de alquinamida estructural, Ynamide, que logra una construcción eficiente y libre de racemización de enlaces amida[5].
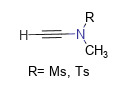
Productos representativos de este tipo de reactivo son N-metiletinil metanosulfonamida (MYMsA) y N-metiletinil p-toluenosulfonamida (MYTsA). Tienen pesos moleculares pequeños, no requieren la adición de catalizadores adicionales, son estables al aire y al agua y pueden obtener casi cuantitativamente la amida objetivo en condiciones casi neutras. Más importante aún, los ácidos carboxílicos que contienen centros α-quirales no sufrirán racemización durante el proceso de condensación. La Figura 1 muestra la fórmula estructural general de los reactivos de acetileno amida [6].
Figura 1
Los reactivos de alquino amida desarrollados por el equipo del profesor Zhao se usan ampliamente y pueden usarse en la síntesis de amidas y fragmentos de péptidos comunes, ésteres y macrólidos, tioamidas, etc. A continuación se presentará en detalle el progreso de la investigación de este tipo de condensación de alquino amida. Reactivos en aplicaciones sintéticas.
1. Utilizado para la síntesis de amidas y péptidos.
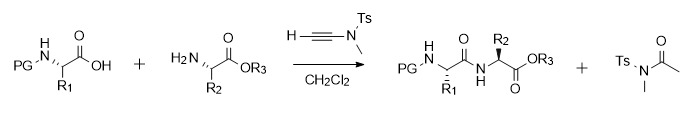
La síntesis de enlaces amida mediada por alquinamida puede proceder de forma espontánea y eficiente tanto en reacciones de activación de ácido carboxílico como de aminolisis. Por lo tanto, el grupo de investigación del profesor Zhao adoptó un método de dos pasos en un solo recipiente, es decir, el intermedio activado no se separó y la reacción posterior con la amina se llevó a cabo directamente, lo que simplificó el proceso de operación. Este esquema tiene buena universalidad. Es aplicable a sustratos con gran impedimento estérico y aminoácidos quirales sin racemización. Además, la reacción mediada por alquinamida no sólo es adecuada para la síntesis de amidas y dipéptidos, sino que también puede usarse para la síntesis de fragmentos de péptidos (como la síntesis de leuencefalina con grupos protectores). Además, este tipo de reactivo de condensación tiene buena tolerancia a muchos grupos funcionales y puede ocurrir en presencia de grupos funcionales de cadenas laterales de aminoácidos como OH, SH, CONH2 y NH del indol [6].
![muy fino muy fino]()
Figura 2 Síntesis de amida
2. Utilizado para la síntesis de ésteres (tioésteres) y macrólidos.
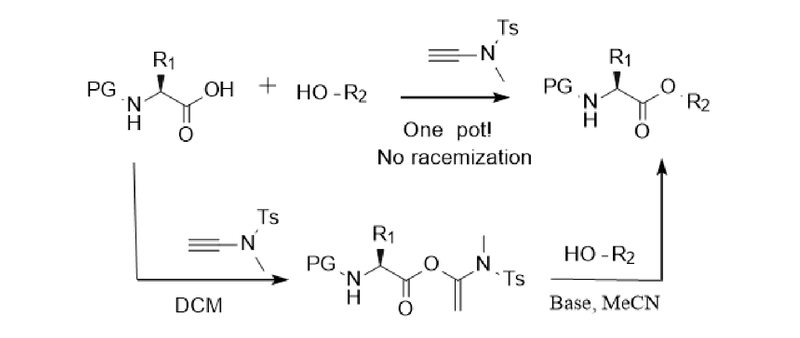
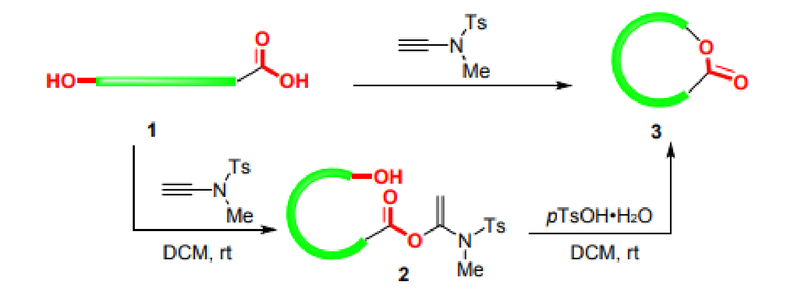
Los enlaces éster son grupos funcionales importantes en muchos productos naturales y productos de química fina. Los ésteres de tiocarbonilo también son intermediarios importantes para la transformación de grupos funcionales. Los macrólidos son los esqueletos centrales de muchos fármacos y productos naturales. Dado que los ésteres activados producidos por la reacción de reactivos de alquino amida con ácidos carboxílicos son estables y pueden almacenarse en un refrigerador hasta por medio año, el grupo de investigación del profesor Zhao amplió aún más la aplicación de reactivos de alquino amida y desarrolló la esterificación intermolecular y la síntesis de macrólidos. esquemas, como se muestra en la Figura 3: En condiciones alcalinas, el acetonitrilo se puede utilizar como disolvente para lograr reacciones de esterificación sin problemas. Para los α-aminoácidos quirales, la racemización también puede evitarse bajo la catálisis de DIEA. Los sustratos son universales y pueden utilizarse para alcoholes (tiólicos) y fenoles (tio). Además, la síntesis de macrólidos presenta problemas como la racemización, la isomerización cis-trans, la polimerización intermolecular y las reacciones secundarias de cierre de anillo, que siempre han preocupado a muchos investigadores. El grupo de investigación del profesor Zhao sintetizó con éxito macrólidos utilizando reactivos de alquino amida (Figura 4). Bajo la catálisis del hidrato de ácido p-toluenosulfónico, todavía se utilizaba el método de dos pasos en un solo recipiente. Los macrólidos se pueden sintetizar con éxito a temperatura ambiente incluso en altas concentraciones, evitando eficazmente problemas como la racemización y la isomerización cis-trans [7,8,9].
![muy fino muy fino]()
Figura 3 Esterificación intermolecular
Figura 4 Síntesis de macrólidos.
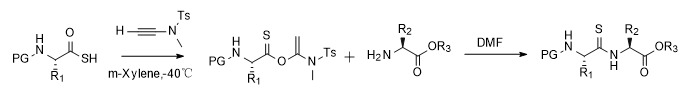
3. Tioamidas y tiopéptidos
La modificación y funcionalización precisa de péptidos y proteínas se han convertido en herramientas indispensables en biología química. Los enlaces de tioamida pueden reemplazar los enlaces peptídicos tradicionales para obtener diferentes propiedades físicas y químicas, como mejorar la resistencia de los péptidos a la degradación enzimática y fabricar sondas con características espectrales únicas. Debido a las limitaciones de los métodos sintéticos, la aplicación de las tioamidas en el campo de la biología de proteínas también es limitada. En respuesta al desafío de introducir enlaces de tioamida en proteínas y péptidos, el grupo de investigación del profesor Zhao Junfeng desarrolló un esquema de síntesis de tioamida mediado por alquino amida. En diclorometano o DMF, las tioamidas se pueden obtener sin racemización. En la síntesis de péptidos en fase sólida, los intermedios de éster activado preparados por ácidos tiocarboxílicos y alquinoamidas se pueden convertir eficientemente en productos objetivo (los 19 aminoácidos naturales excepto la histidina), sentando así las bases para el estudio de las tioamidas en la biología química de los péptidos. y proteínas [10,11].
![muy fino muy fino]()
Figura 5 Síntesis de tioamida.
Los agentes de condensación de alquinamida no solo tienen las ventajas de los reactivos de condensación tradicionales y los ésteres activados, sino que también compensan sus deficiencias. Proporcionan nuevos métodos para la síntesis de sustancias importantes como amidas y polipéptidos, ésteres y macrólidos y tiopéptidos, y tienen una importante importancia científica en el campo de la síntesis de polipéptidos y proteínas. Además, gracias a los esfuerzos de nuestros investigadores científicos, Suzhou Haofan ha podido proporcionar reactivos de condensación de alquinamida. Al mismo tiempo, nuestra empresa está comprometida con la investigación, el desarrollo y la producción de reactivos de síntesis de amidas y polipéptidos. Después de 20 años de desarrollo y acumulación, nuestra empresa se ha convertido en el proveedor de reactivos de síntesis de amidas más grande y completo del mundo. Ya están a la venta los reactivos de condensación de primera a cuarta generación. Los amigos con necesidades pueden llamarnos para realizar consultas.
referencias:
[1] Boström, J.; Brown, director general; Joven, RJ; et al. Ampliando la caja de herramientas sintéticas de química medicinal [J]. Nat. Rev. Droga. Descubrimiento. 2018, 17, 709-727.
[2] Las 200 drogas principales de 2019: el cartel. https://www. pharmaexcipients.com/news/top-200-drugs-2019/ (consultado el 18 de diciembre de 2021)
[3] Magano, J. Amidaciones a gran escala en la química de procesos: consideraciones prácticas para la selección de reactivos y la ejecución de reacciones[J]. Org. Resolución de proceso. Desarrollo. 2022, 26, 1562-1689.
[4] Bryan, MC; Dunn, PJ; Entwistle, D.; et al. Se revisan las áreas clave de investigación de la química verde desde la perspectiva de los fabricantes farmacéuticos [J]. Química verde. 2018, 20, 5082-5103.
[5] Liu, T.; Xu, SL; Zhao, JF Avances recientes en el reactivo de acoplamiento de ynamida [J]. Mentón. J. Org. Química. 2021, 41, 873-887.
[6]Hu, L.; Xu, SL; Zhao, JF; et al. Ynamidas como reactivos de acoplamiento libres de racemización para la síntesis de amidas y péptidos [J]. Mermelada. Química. Soc. 2016, 138, 13135-13138.
[7] Wang, XW; Yang, Y.; Zhao, JF; et al. Esterificación intermolecular mediada por ynamida [J]. J. Org. Química. 2020, 85, 6188-6194.
[8] Yao, CC; Yang, JH; Zhao, JF; et al. Síntesis de tionoésteres y ditioésteres mediadas por ynamida [J]. Org. Letón. 2020, 22, 6628-6631.
[9] Yang, M.; Wang, XW; Zhao, JF Macrolactonización mediada por ynamida [J]. ACS Catal. 2020, 10, 5230-5235.
[10] Yang, JH; Wang, CL; Xu, SL; Zhao, JF Síntesis de tiopéptidos mediada por ynamida [J]. Angélica. Química. En t. Ed. 2018, 58, 1382-1386.
[11] Yang, JH; Wang, CC; Zhao, JF; et al. Incorporación específica de sitio de múltiples sustituciones de tioamida en una estructura peptídica mediante síntesis de péptidos en fase sólida [J]. J. Org. Química. 2020, 85, 1484-1494.